
Intranazální očkování proti chřipce pro děti
Nabídněte rodičům malých pacientů jednoduchou ochranu proti chřipce. Fluenz je živá, atenuovaná nosní vakcína proti chřipce, která chrání ty nejzranitelnější pacienty: děti a mladistvé.

Nabídněte rodičům malých pacientů jednoduchou ochranu proti chřipce. Fluenz je živá, atenuovaná nosní vakcína proti chřipce, která chrání ty nejzranitelnější pacienty: děti a mladistvé.
Vážená paní doktorko, vážený pane doktore,
děkujeme, že díky očkování pomáháte chránit děti proti chřipce. Pokud máte nevyočkované dávky s expirací 01/2023, kontaktujte prosím svého distributora s požadavkem na vrácení a kompenzaci do 10.2.2023.
Děkujeme za spolupráci.

Ing. Lenka Gerling, MBA
Sales & Marketing Manager Respiratory & Immunology CZ
AstraZeneca EMEA | Czech Republic
Telefon: +420 721 041 871
E-mail: lenka.gerling@astrazeneca.com
Rozprašovač vakcíny Fluenz je navržen tak, aby vakcína byla aplikována ve formě jemné mlhy. Pokud je na píst při podávání vakcíny vyvíjen správný tlak, je vysoce nepravděpodobné, že by vakcína byla aplikována jako proud namísto mlhy. Pokud je však píst stlačen nedostatečnou silou a příliš pomalu, část dávky může být ve formě kapek. Je potřeba, aby při aplikaci vakcíny byl píst stlačen s dostatečnou silou tak, aby celá dávka byla aplikována ve formě jemné mlhy.
Pokud podstatná část aplikované dávky vakcíny z nosní dírky vytéká, měl by být nos otřen papírovým kapesníkem, který by pak měl být zlikvidován v souladu s místními postupy. Měla by být dodržena řádná hygiena a pacient a zdravotnický pracovník by si měli umýt ruce nebo jinou exponovanou pokožku mýdlem a vodou nebo dezinfekčním čisticím prostředkem na ruce. Druhá polovina dávky by měla být podána do druhé nosní dírky.
Předepsaná dávka (0,2 ml; 0,1 ml na nosní dírku) obsahuje více virových částic, než je zapotřebí k vyvolání infekce. Zatímco vakcína obsahuje přibližně 107 infekčních jednotek každého ze čtyř virových kmenů vakcíny, dávka potřebná k infikování poloviny skupiny očkovaných dospělých (lidská infekční dávka, 50 %) je přibližně 10‒100krát nižší a pro děti až 1000krát nižší. K navázání virů na epitelové buňky v nosohltanu dojde rychle a úspěšnost očkování závisí především na pokračujícím šíření virů po počátečním zachycení z podané dávky. Množení viru u dospělých trvá několik dnů, a u některých dětí i déle než jeden týden.
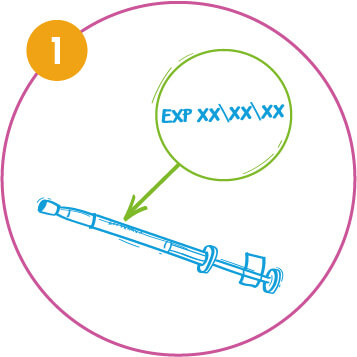
Zkontrolujte datum expirace. Přípravek musí být použit před datem uvedeným na označení aplikátoru.
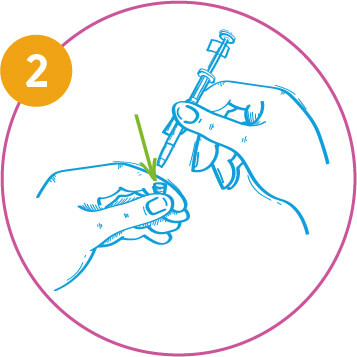
Připravte aplikátor. Odstraňte kryt gumové špičky aplikátoru. Neodstraňujte svorku rozdělovače dávky na opačném konci aplikátoru.
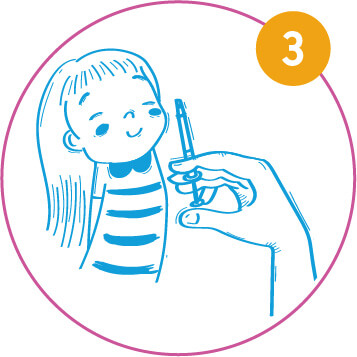
Zavedení aplikátoru. Pacient je ve vzpřímené pozici. Zaveďte špičku aplikátoru do nosní dirky jen tak daleko, aby bylo jisté, že vakcína Fluenz bude skutečně aplikována do nosní dutiny.
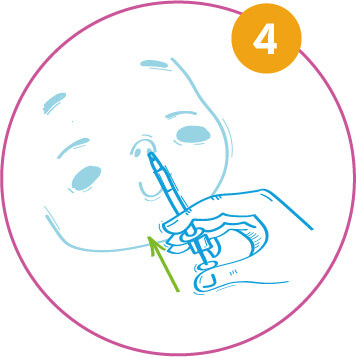
Stiskněte plunžrový píst. Jedním co nejrychlejším pohybem stlačte píst aplikátoru tak, až spona rozdělovače dávky zastaví další pohyb.
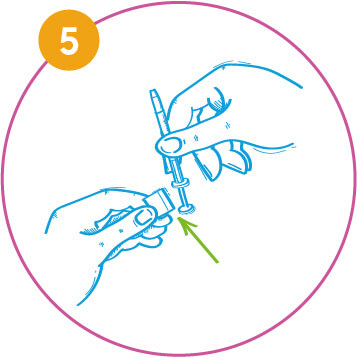
Před podáním vakcíny do druhé nosní dírky stlačením odstraňte sponu rozdělovače dávky aplikátoru.
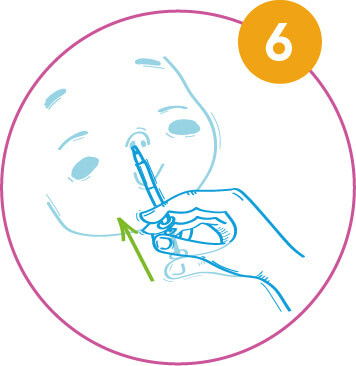
Zaveďte špičku aplikátoru do druhé nosní dirky a jedním co nejrychlejším pohybem stlačte píst a aplikujte zbývající množství vakcíny.

Údaje o bezpečnosti použití přípravku Fluenz jsou založené na údajích z klinických studií přípravku Fluenz na více než 29000 dětech a dospívajících ve věku 2 až 17 let a ze studií bezpečnosti po registraci přípravku na více než 84000 dětech a dospívajících ve věku 2 až 17 let a údajích z klinických studií přípravku Fluenz Tetra (živá atenuovaná, nazální vakcína proti chřipce) na více než 2 000 dětí a dospívajících pacientů ve věku 2 až 17 let. Další zkušenosti byly získány během používání přípravku Fluenz a Fluenz Tetra po jeho uvedení na trh.
V klinických studiích byl bezpečnostní profil přípravku Fluenz podobný bezpečnostnímu profilu vakcíny Fluenz Tetra.
Nejčastějším nežádoucím účinkem pozorovaným v klinických studiích byly nazální kongesce/vodnatý výtok z nosu.
Seznam nežádoucích účinků
Četnost výskytu nežádoucích účinků je uvedena jako:
Velmi časté (≥ 1/10)
Časté (≥ 1/100 až < 1/10)
Méně časté (≥ 1/1000 až < 1/100)
Vzácné (≥ 1/10000 až < 1/1000)
Velmi vzácné (< 1/10000)
Poruchy imunitního systému
Méně časté: Hypersenzitivní reakce (včetně edému obličeje, kopřivky a
velmi vzácných anafylaktických reakcí)
Poruchy metabolismu a výživy
Velmi časté: Snížená chuť k jídlu
Poruchy nervového systému
Časté: Bolest hlavy
Respirační, hrudní a mediastinální poruchy
Velmi časté: Nazální kongesce/vodnatý výtok z nosu
Méně časté: Epistaxe
Poruchy kůže a podkožní tkáně
Méně časté: Vyrážka
Poruchy svalové a kosterní soustavy a pojivové tkáně
Časté: Myalgie
Celkové poruchy a reakce v místě aplikace
Velmi časté: Malátnost
Časté: Horečka24
Nejsou k dispozici žádné údaje, které by naznačovaly, že očkování přípravkem Fluenz bude mít negativní dopad na imunitní systém nebo zvýší pravděpodobnost onemocnění COVID-19.
Neexistují žádné důkazy o tom, že podání vakcíny proti chřipce zvyšuje riziko vzniku nemoci COVID-19.
Očkování se neprovádí u osob, které jsou v karanténě nebo izolaci pro onemocnění COVID-19 nebo mají zvýšenou tělesnou teplotu a příznaky akutního onemocnění. Po prodělaném onemocnění je očkování možné po uplynutí doby rekonvalescence v délce podle závažnosti průběhu, obvykle po 7‒14 dnech (zdroj ČVS očkování v době epidemie). Případná nepoznaná inkubační doba onemocnění COVID-19 u osoby bez klinických známek onemocnění není kontraindikací očkování.
Očkování není hrazeno z veřejného zdravotního pojištění. Rodiče mají možnost požádat svoji zdravotní pojišťovnu o úhradu z programu prevence.
| POJIŠŤOVNA | KÓD POJIŠŤOVNY | PŘÍSPĚVEK |
|---|---|---|
| Všeobecná zdravotní pojišťovna | 111 | na očkování až do výše 300 Kč |
| Vojenská zdravotní pojišťovna České republiky | 201 | na očkování až do výše 1 500 Kč |
| Česká průmyslová zdravotní pojišťovna | 205 | na nepovinné očkování až do výše 1 500 Kč |
| Oborová zdravotní pojišťovna zaměstnanců bank, pojišťoven a stavebnictví | 207 | na očkování proti chřipce až do výše 500 Kč |
| Zaměstnanecká pojišťovna Škoda | 209 | na očkování proti chřipce až do výše 400 Kč |
| Zdravotní pojišťovna Ministerstva vnitra České republiky | 211 | na očkování až do výše 2 000 Kč |
| Revírní bratrská pojišťovna | 213 | na očkování až do výše 1 000 Kč |
Vakcínu pro vaše dítě ve věku od 24 měsíců do 18 let může předepsat jen praktický lékař pro děti a dorost, očkování může být dostupné i přímo v ordinaci vašeho registrujícího lékaře za úhradu, u rizikových skupin dětí hradí očkování zdravotní pojišťovny. Aplikace probíhá v ordinaci.
Vakcínu nelze zakoupit bez lékařského předpisu.
Nejvhodnější je doba před začátkem chřipkové sezony. Chřipkové epidemie postihují Českou republiku v chladných měsících roku, nejčastěji mezi prosincem až březnem. Nové vakcíny pro danou sezonu se na trhu obvykle objevují v září. Ideální dobou k očkování jakoukoliv chřipkovou vakcínou je říjen až prosinec. Cílem je zachovat optimální účinnost vakcíny proti chřipce po celou dobu trvání chřipkové epidemie.
Obsahuje vakcína Fluenz thiomersal?
Vakcína je bez obsahu thiomersalu.
Je v aplikátoru vakcíny obsažen latex?
Vakcína Fluenz je plně vyrobena z „latex free“ produktů. Není ovšem možné potvrdit, že vakcína nepřišla do kontaktu s latexem během výrobního procesu. Rozhodnutí o vakcinaci pacientů s hypersenzitivitou na latex je tedy na klinickém rozhodnutí ošetřujícího lékaře.
Obsahuje vakcína Fluenz síru, laktózu, ořechy, gluten, formaldehyd, stopy rybích produktů, měkkýšů či korýšů, aminoglykosidy či hliník?
Ne, vakcína Fluenz neobsahuje výše uvedené.
Obsahuje vakcína Fluenz antibiotika?
< 0,015 mcg/ml gentamicinu je obsaženo v dávce 0,2 ml.
Od roku 1980, kdy byla poprvé hlášena souvislost mezi Reyeho syndromem a užíváním aspirinu v průběhu infekce varicella nebo chřipce podobného onemocnění, jsou orgány veřejného zdraví opakovaně vydávána varování před užíváním aspirinu u dětí s virovým onemocněním.10,17 Existuje silné a epidemiologicky konzistentní spojení mezi užíváním salicylátů (zejména kyseliny acetylsalicylové/aspirinu) v průběhu virové infekce a rizikem rozvoje Reyeho syndromu. Mnohé studie případů a kontrol ukazují, že užívání salicylátů v souvislosti s virovým onemocněním je silným rizikovým faktorem. Retrospektivní studie případů Reyeho syndromu poukazují na zvyšující se riziko závažnosti syndromu s rostoucími koncentracemi salicylátu v séru.
Vakcína může obsahovat rezidua následujících látek: vaječné bílkoviny (např. ovalbumin) a gentamicinu. Maximální množství ovalbuminu je menší než 0,024 mikrogramů na 0,2 ml dávky (0,12 mikrogramů na ml).
Vakcína Fluenz se nemá podávat dětem a dospívajícím s těžkým astmatem nebo aktivním sípotem, protože tyto osoby nebyly v klinických studiích dostatečně studovány.
Příjemci vakcíny by měli být informováni o tom, že Fluenz je oslabená živá virová vakcína a má potenciál přenosu viru na osoby s poruchou imunity. Příjemci vakcíny, je-li to možné, by se měli po dobu 1‒2 týdnů po očkování vyhýbat blízkému kontaktu s osobami s těžce narušenou imunitou (například jedinci po transplantaci kostní dřeně, kteří vyžadují izolaci). V klinických studiích s vakcínou Fluenz byl nejvyšší výskyt při izolaci viru vakcíny 2‒3 dny po vakcinaci. V případech, kdy je kontakt s osobami se závažnou poruchou imunity nevyhnutelný, je třeba zvážit potenciální riziko přenosu oslabeného chřipkového viru vakcíny proti riziku nákazy divokým typem chřipkového viru a jejího šíření.
Následující stránky a informace jsou určeny výhradně odborníkům, tedy osobám oprávněným léčivé přípravky předepisovat, nebo vydávat (definice odborníka podle § 2a zákona č. 40/1995 Sb., o regulaci reklamy, ve znění pozdějších předpisů). V případě, že tomu tak není, je si tato vstupující osoba vědoma rizik spojených s chybným vyhodnocením tvrzení uvedených v reklamě.
Přejete-li si pokračovat, a tím potvrdit, že jste odborníkem, stiskněte ANO.
Děkujeme vám za objednávku vakcín Fluenz.
V nejbližších dnech vám emailem zašleme potvrzení, že jsme vaši objednávku za AstraZeneca zpracovali. Neváhejte se na mě obrátit s jakýmikoliv dotazy k vakcíně Fluenz.

Ing. Lenka Gerling, MBA
Sales & Marketing Manager Respiratory & Immunology CZ
AstraZeneca EMEA | Czech Republic
U Trezorky 921/2, Jinonice, 158 00 Praha 5
Telefon: +420 721 041 871
E-mail: lenka.gerling@astrazeneca.com